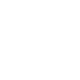产品中心
-
锁相放大器
-
单光子探测
-
量子信号测控设备
-
信号放大器
-
激光器
-
精密源
-
滤波器
-
荧光寿命分析
-
物性测试设备
解决方案
利用实时控制提高NV色心测试
|生物电阻抗谱
|霍尔效应
|OPM光泵浦磁强计
|传感器的阻抗测量
|MEMS 陀螺仪
|基于MEMS的传感器
|超导量子计算测量方案
|时域热反射谱(TDTR)
|光学锁相环
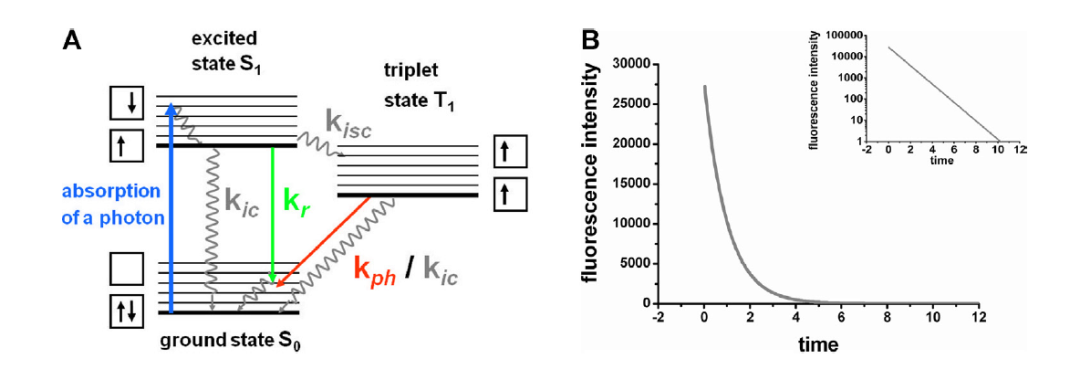
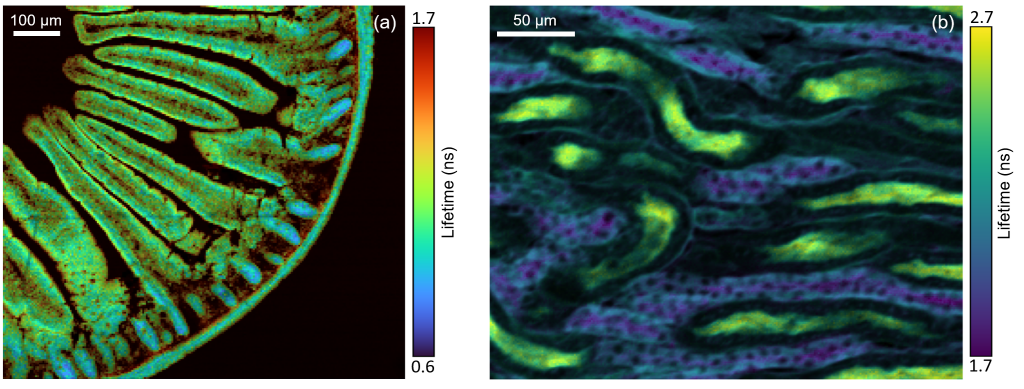
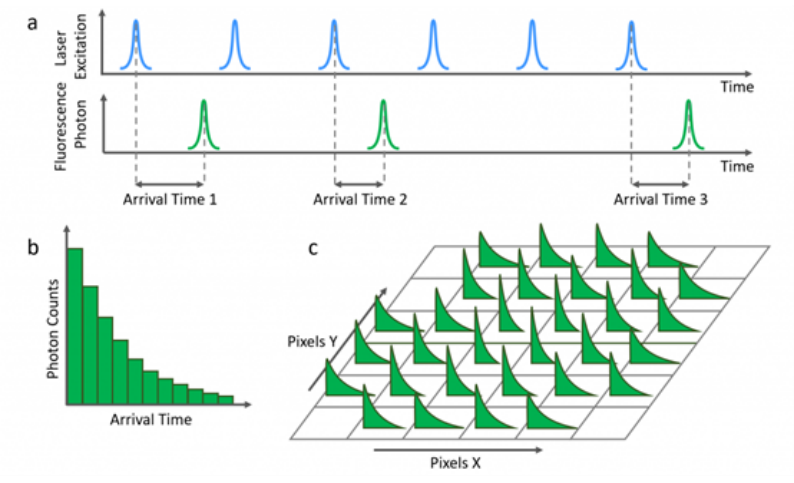
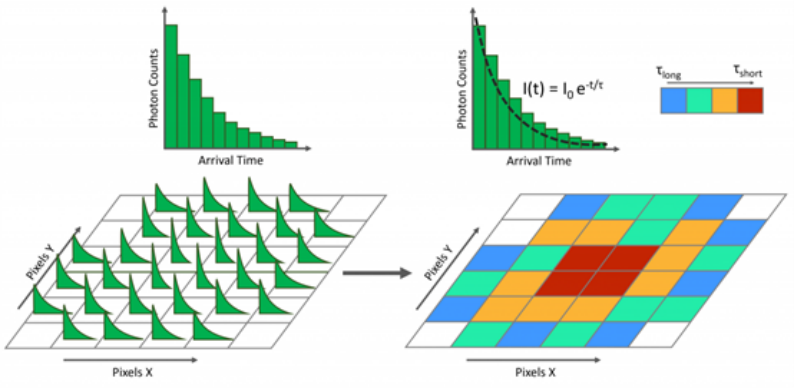
|什么是 FLIM 荧光寿命成像?
|传感器的阻抗测量
|基于 NV 色心系综的磁强测量
|微流控/单细胞检测和分类
|扫描近场显微术 (SNOM)
|开尔文探针力显微镜 (KPFM)
|泵浦-探测光谱
|深能级瞬态光谱检测(DLTS)
|光致发光
|激光电压探测和成像
|双频共振跟踪 (DFRT-AFM)
|非接触式原子力显微镜 (NC-AFM)
|多频原子力显微镜 (MF-AFM)
|金刚石氮-空位 (NV) 色心的相干控制
|荧光寿命成像
|可调谐半导体激光吸收光谱
|拉曼光谱
|太赫兹时域光谱
|量子反馈控制
|基于自旋的量子计算
|原子力显微镜成像
|动态电阻抗测试系统
010-58237058






 010-58237058
010-58237058